Genetikai tényezők és alapfogalmak
A különböző betegségek patogenezisében genetikai és környezeti tényezők egyaránt szerepet játszanak. Ezek súlya egy adott betegségben változó, de ismereteink mélysége is változik. A genetika ma nem elsősorban a mendeli genetikát jelenti (bár annak értéke ma sem vitatható), hanem a molekuláris genetikát, amelynek robbanásszerű fejlődése már eddig is sok betegségről alkotott képünket átalakította, és valószínű, hogy a közeljövőben egyre inkább napi, klinikai gyakorlati jelentőséget is szerez.
Emberi genom feltérképezése
A betegségek genetikai megismerése részben epidemiológiai és családfa vizsgálatokat, részben molekuláris genetikai kutatást jelent, amelynek célja a genom minél alaposabb megismerése. Az emberi genom szekvenciájának „térképszerű” megismerése (Humán Genom Organisation: HUGÓ) korántsem jelentett végleges megoldást, inkább a kutatások jelentős felgyorsulásához vezetett.
Gének
Jelen genetikai ismereteink szerint a humán genomot a korábban feltételezettnél (-100 000) lényegesen kevesebb, kb. 30-40 000 gén alkotja, ezzel (legalábbis genetikai szempontból) kb. egy rizsszem összetettségét közelítjük meg. Az alábbiakban a legfontosabb genetikai alapfogalmak és módszerek leírását adjuk közre, amely remélhetőleg hozzájárul a genetikai cikkek könnyebb megértéséhez a gasztroenterológia területén kívül is.
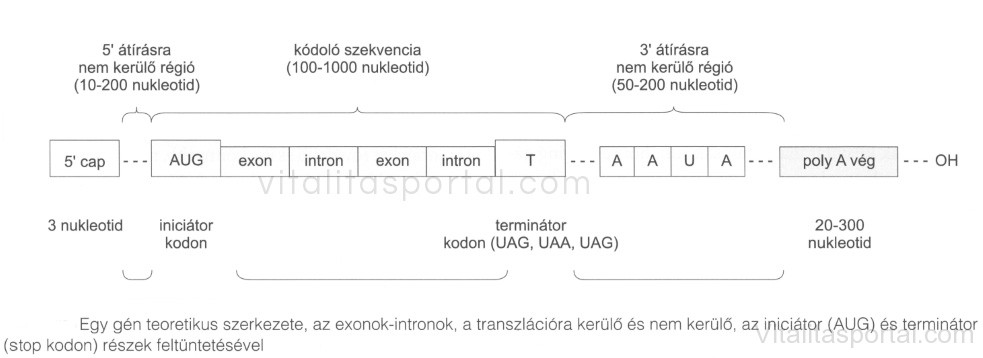
A genetikai alapegység a gén, amelyen egy bizonyos fehérje kódolásáért felelős DNS-szakaszt értünk A gén átíródó szakasza az exon, ami végül is RNS-sé íródik át, kódolhat transzfer (t)RNS-t, riboszomalis (r)RNS-t, vagy magát a fehérjét. A nem átíródó szakaszok az intronok, illetve az 5′ vagy 3′ nem átíródó régiók, amik az exonok között helyezkednek el. Az RNS érése során a prekurzor RNS-ből az exonok eltávolításra kerülnek.
Emberi genom
A normális emberi genom kifejezetten variábilis, a mai ismereteink szerint kb. 1,5-2,5 millió genetikai variációt jelentő SNP (single nucleotid polymorphism) hely figyelhető meg, átlagosan 1000-2000 bázisra esik egy SNP. Az SNP-en a DNS-szekvenciában megfigyelhető genetikai variációt értjük, amely a DNS-szekvenciában adott fajra, populációra, betegségre jellemző helyeken egyes nukleotid-cseréhez (G-C- vagy A-T-cseréhez), és ezáltal biallél-variációkhoz vezet.
Többek között ez a magyarázata a megfigyelhető egyéni külső és belső különbségeknek és persze a különböző környezeti hatásokkal szembeni eltérő fogékonyságnak. Az SNP önmagában persze még nem jelent mutációt.
Polimorfizmus
Gyakran öröklődő, populációra jellemző genetikai variációt kódol, amely az esetek többségében önmagában nem jár a gén által kódolt fehérje megváltozásával, de más genetikai és környezeti faktorhoz kapcsolódva befolyásolhatja az adott fehérje működését.
Az ilyen variánsokat nevezzük polimorfizmusnak. A DNS két szálán egy bizonyos locusnak (génnek) megfelelő DNS-szekvenciákat alléleknek nevezzük. A populációra jellemző alléit nevezzük vad típusnak, míg a ritkábban előforduló változatokat variáns allélnek. Heterozigóta egyénben a DNS-szekvencia a két DNS-láncon különbözik, míg homozigótákban a DNS-szekvencia a két DNS-láncon azonos. Az ún. kevert (compound) heterozigótákban a DNS mindkét láncán detektálható eltérés a vad típustól, de az a két láncon egymástól különböző. Genotípuson pedig mindkét DNS-lánc egy adott pozíciójában található szekvenciáját értjük.
Mutációk és hibák
Örökölten (germline) vagy a replikáció során képződve azonban olyan hibák is előfordulhatnak, amelyek végül a kódolt fehérje funkcióját alapvetően befolyásolják. Előfordulhat, hogy egyáltalán nem jön létre a fehérje, vagy annak működőképessége részben vagy egészben hiányzik. Ilyenkor génmutációról beszélünk, ami érinthet akár egy bázispárt is (pl. deléció: DNS-szekvenciából egy nukleotid kiesik, vagy inzerció: olyan mutáció, amely során a DNS-szekvenciába egy plusz nukleotid épül be, egy aminosav cseréjével jár).
Lehet ennél kiterjedtebb változás is (pl. frame shift mutáció: az aminosav-sorrendet kódoló tripletek sorrendjében bekövetkező mutáció, amely miatt a tripletek sorrendje elcsúszik, ezért a sorban következő összes aminosav megváltozhat).
Kromoszomális eltérések
Természetesen előfordulnak nagyobb DNS-területet érintő kromoszomális eltérések, törések, átrendeződések is (kromoszomális instabilitás). A fehérje funkciója kieshet azonban a DNS károsodása nélkül is, ún. epigenetikus hibák révén (pl. a DNS-metiláció megváltozása miatt). A DNS metiltranszferáz enzim minden egyes egyénben egy jellegzetes metiláltsági állapotot alakít ki. Ennek megváltozása, pl. a gének promoter régiójának hipermetilációja, a gén expresszióját, működését befolyásolja. Idősebb korban a metiláltsági állapot kedvezőtlenül változik.
Mikroszatellita instabilitás (MSI)
Ugyanígy a közelmúltban került felismerésre a mikroszatellita instabilitás (MSI) jelentősége. A mikroszatelliták rövid (kb. 6-25 nukleotid hosszúságú) repetitív szekvenciák, általában a DNS nem kódoló szakaszán belül. Lehetnek mono-, di-, tri-, tetranukleotid ismétlődések, gyakori ezek hibája (RERs: replication errors). Klinikai jelentőségét az adja, hogy kódoló szakaszokat is érinthet (mismatch repair gének, TGR RII, IGF2R, BAX, Bat26 stb.).
Az MSI szempontjából megkülönböztethetők MSI-H (a mikroszatellita locusok több mint 30-40%-a hibás), MSI-L (< 30%) és MSS (microsatellite stable), azaz MSI-t nem mutató DNS régiókat-állapotokat. Hasonlóan ismétlődő szekvenciákból állnak a telomérák, a kromoszómák végén rövid, kb. 10-20 bázispárból álló, ismétlődő DNS-szakaszok (pl. TTAGGG). Ezek funkciója a kromoszómavégek cappingje (védelme).
A sejtosztódás, öregedés során ezek a DNS-szakaszok rövidülnek, bizonyos kritikus rövidülésük sejtosztódási képtelenséghez, majd sejtkrízishez, apoptózishoz vezet. A regenerációjukat végző enzim (telomeráz) csak őssejtekben aktív, érett sejtekben az enzim újraaktiválódása más hibákkal együtt a programozott sejthalál elkerüléséhez, tumoros transzformációhoz vezethet.
Hibák a sejtben: daganatok
Hibák persze a sejtosztódás során gyakran keletkeznek, életünk során naponta több ezer sejtben keletkeznek olyan mutációk, amelyek végül korlátlan sejtproliferációhoz, köznapi értelemben daganat képződéséhez vezethetnének. Ehhez egy adott sejtben 3-4, funkciójában jelentős mutációnak együttesen kell jelen lennie. De miért is nem hal meg akkor mindenki daganatos megbetegedésben? Szerencsére fejlett javító, védekező mechanizmusok segítik a hibák kijavítását, vagy amennyiben nem lehetséges, utasítást adnak a sejtnek a programozott sejthalálra (apoptózis).
Ilyen fontos védő-javító mechanizmusok pl. a mismatch repair (MMR) gének, amelyek a DNS megkettőződésekor keletkezett hibák kijavításában fontosak (ún. housekeeping gének). Hasonlóan alapvetően fontosak a sejtciklus fázisait szabályozó gének (ún. tumorszupresszor gének/fehérjék), amelyek a sejtosztódást szabályozó „fék” funkciót látnak el [pl. Gl/S fázisátmenetet szabályozó pRB (pl6-Rb-ciklin Dl) és p53 (p53-MDM2-p21) kaszkád vagy a G2/M fázis regulációjában fontos ciklin Bl].
A betegségek kialakulásában szerepet játszó genetikai ok lehet egy génhez kötött (monogénes). Ezek a mendeli szabályok szerint autoszomális domináns vagy recesszív módon, vagy pl. nemhez kötötten öröklődnek. A betegségek többségében azonban számos gén és a környezet interakciója vezet végül a betegség megjelenéséhez (poligénes betegség).
Fontos megemlíteni, hogy még a monogénes betegségek esetén is számos különböző mutáció lehetséges, mint pl. Wilson-betegség vagy familiáris adenomatosus polyposis (FAP) esetén is Végül még egy fogalmat meg kell említeni. Amennyiben megfelelő statisztikai módszerekkel bizonyos génvariáns (ok) kapcsolatba hozható(k) bizonyos betegségekkel, vagy a betegség progressziójával-lefolyásával, akkor az adott gént hajlamosító génnek (candidate gene) nevezzük. Az újabb genetikai módszerek azonban egyszerre akár több ezer, több millió génvariáns vizsgálatát lehetővé teszik, így a betegségkörnyezet és a genom kapcsolatának együttes vizsgálata speciális statisztikai-matematikai módszerek kidolgozását tette szükségessé.
Tovább: Genetikai vizsgáló módszerek

Szerző: Griffel Tibor
Végzettség: ELTE – Eötvös Loránd Tudományegyetem. Szakterület: a szív- és érrendszeri betegségek, gasztroenterológiai betegségek és a légzőrendszeri betegségek. Jelenleg reflexológus, életmód és tanácsadó terapeuta tanulmányokat is végzek.