Genetikai tényezők és az emésztőrendszeri betegségek kapcsolata
Monogénes betegségek
A betegségek kialakulásában szerepet játszó genetikai ok lehet egy génhez kötött (monogénes, ezek a mendeli szabályok szerint autoszomális domináns, vagy recesszív módon, vagy pl. nemhez kötötten öröklődnek), illetve poligénes. A betegségek többsége természetesen a második csoportba tartozik, és még a monogénes betegségek esetén is számos különböző mutáció lehetséges; így pl. a Wilson-betegség vagy familiáris adenomatosus polyposis (FAP) esetén is az adott gén több száz különböző mutációját írták le.
Wilson-betegség (rézanyagcsere betegsége)
Szerencsés esetben van legalább is egy adott földrajzi területre jellemző mutáció. A Wilson-betegség esetén ez a helyzet. A Wilson-kór génje a 13. kromoszómán található (13q14.3-q21.1), a betegséget ennek a génnek (ATP7B) a mutációja okozza, amit 1993-ban írtak le először. A gén hibája miatt kóros az ATP7B réztranszportáló protein működése, ezért a réz nem tud a coerulo-plasminba beépülni, illetve az epével távozni, így toxikus mértékben halmozódik fel a májban, az agyban, a corneában és más szervekben.
A réztranszporter génnek ugyan több mint 300 mutációja ismert, de Közép-Európában, és így Magyarországon is a H1069Q mutáció mutatható ki a betegek 70-80%-ban, míg az összes többi mutáció előfordulása igen ritka. A mutáció tesztelése így viszonylag egyszerű PCR-RFLP-vel lehetséges, ami a teszt diagnosztikus alkalmazását lehetővé teszi.
A helyzet tehát általában még monogénes betegségek esetén sem egyszerű, mivel bizonyos DNS-eltérések a normál variáns részét képezik (polimorfizmus), a határ a variáns és a genetikai mutáció között nem éles. Sokszor igen nehéz így azt eldönteni, hogy a talált eltérés egy eddig nem ismert, ritka variáns, aminek funkcionális következményét nem sikerült kimutatni, vagy nem vizsgálták, valójában mutációnak vagy „csak” polimorfizmusnak tekintendő.
Példák a monogénes betegségekre
Erre további jó példa az autoszomális recesszív haemochromatosis, ami ugyan az újabb adatok szerint szintén nem monogénes betegség (ismert asszociációt mutató gének: HFE, HAMP, HJV, TFR2 és SCL40A1), de a klasszikus esetek 80-90%-át a HFE-gén mutációjával hozzák kapcsolatba. A két gyakori polimorf/mutációs hely a C282Y és a hasonló, de enyhébb funkcionális következményekkel járó H63D. Később kiderült, hogy a klasszikus HFE mutációk penetranciája kisebb (-1%), mint azt korábban gondolták, pl.
- Köhögés és köpettel járó köhögés okai
- Rekedtség okai
- A járás zavara: sántítás és ataxia
Ezek a cikkek is érdekelhetnek:
Poligénes betegségek
A betegségek többsége eleve poligénes, azaz különböző, a rizikót fokozó és védő hatású génvariációk, és a környezeti hatásokkal együttesen járulnak hozzá a betegség kialakulásához, és határozzák meg a klinikai fenotípust.
Példaként ismét csak a kolorektális carcinoma esetét hozhatnánk fel. A kolorektális rák genetikájának vizsgálata a gasztrointesztinális kutatások egyik sikertörténete. Ennek oka részben az, hogy a családi öröklődést mutató ráktípusok viszonylag nagy számban fordulnak elő, másrészt a premalignus polipok és adenomák gyakoriak, és könnyen azonosíthatók, illetve hozzáférhetők. Az 1990-es években a jól ismert adenoma-carcinoma szekvencia átalakulásért felelős genetikai eltérések egymás után váltak ismertté. A karcinogenezis azonban itt is különböző utakon jöhet létre.
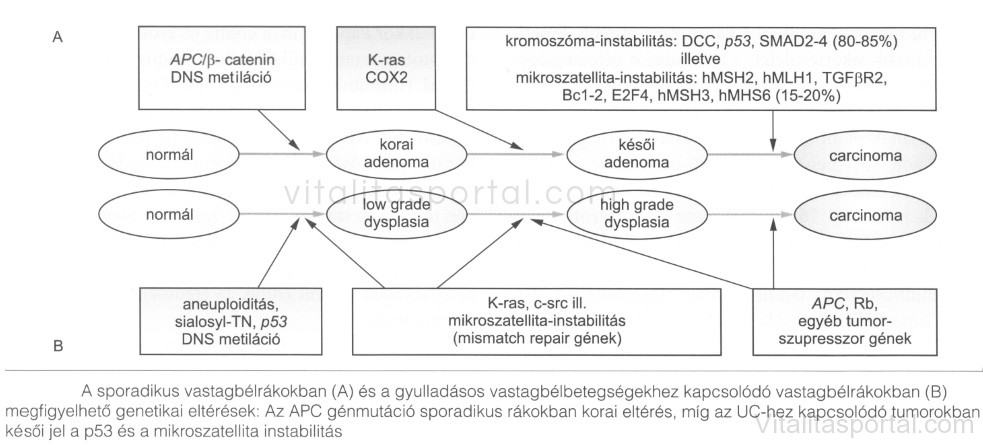
A lehetséges mechanizmusok sporadikus daganatok esetén: a kromoszomális instabilitás (jellegzetes gének: APC, K-ras, p53, DCC), a mikroszatellita instabilitás (mismatch repair gének hibája), és részben ezekkel összefüggően a DNS-metiláció megváltozása. Az elmúlt egykét évben elkészült GWAS-eredmények (pl. 11q23, 8q24, 18q21 és 10q14) alapján újabb fontos gének-géncsoportok azonosítása várható. Kiderült azonban az is, hogy ebben az esetben sincsenek sine qua non mutációk, szinkron léziókban is különbözők lehetnek a genetikai hibák. Hasonló, de a genetikai lépések sorrendjét illetően különböző a colon-carcinogenesis a colitis ulcerosához kapcsolódó tumorgenezis során. (Lásd a lenti képen!)
A kolorektális rákhoz hasonlóan egyre jobban megismerjük a genetikai lépések egymásutánját primer májsejtcarcinomák (HCC) és pancreas adenocarcinomák esetén is. Míg máj daganatokban a TGFfi, RB és hipo/ hipermetiláció viszonylag korai eltérések, addig a wnt/b-catenin, p53 mutációja, heterozigozitás elvesztése és kromoszomális instabilitás inkább késői jellegzetességek a hepatocarcinogenesis során. A MAPK (mitogen-activated protein kinase) aktivációja ugyanakkor elsősorban a hepatitis-B és -C vírusokhoz kapcsolódó carcinogenesis során figyelhető meg.
DNS-mutációk és genetikai sérülések
A mutációk túlélés esetén a sejtek számára proliferációs előnyt jelentenek. A DNS-mutációk fölött egy állandó, ellenőrző, reparációs mechanizmus őrködik, amennyiben ez a hibákat nem tudja korrigálni, programozott sejthalált (apoptózist) indukál. A tumorgenezis-modellek éppen ezeket, a normális sejt rákos transzformációjának egymást követő genetikai és morfológiai lépéseit próbálják megmagyarázni.
Az újabb kutatások alapján ma már tudjuk, hogy nincsen egy közös út, a genetikai sérülések különböző mechanizmusok útján (pl. mikroszatellita instabilitás, kromoszomális instabilitás, DNS-metiláció) vezetnek végül is a rák kialakulásához. Fontos továbbá, hogy a különböző utak egy bizonyos esetben együtt is jelen lehetnek, azaz a rákok többsége genetikailag is heterogén. Még izgalmasabb kérdés, hogy bizonyos genetikai eltérések benignus betegségekben is kimutathatók, így ezek interpretációja igen nagy körültekintést igényel.
A patogenezis mind részletesebb megértésén túl a genetikai háttér megértése hozzájárul új terápiás célpontok azonosításához, a klinikai paraméterekkel együtt segíthet a prognózis (pl. MSI) és esetenként a kemoterápiára adott válasz (pl. K-ras mutáció és cetuximab) pontosabb előrejelzésében, ezzel megteremtve a lehetőségét az egyre inkább egyénre szabottabb terápiának.
Kérdés tehát, hogy bármelyik gén vagy ezek kombinációjának vizsgálata segítheti-e a diagnózist vagy a terápiás döntéshozatalt poligénes betegségeknél? A válasz: talán, a limitáló tényezők figyelembevételével.
Mit jelent ez?
Elsősorban azt, hogy a génmutáció-variáns kimutatása az adott betegben nem bizonyítja, illetve annak hiánya nem zárja ki a betegséget. Azaz a klinikai és laboratóriumi leletek közül csupán egy olyan tényező, amely pozitivitás esetén a diagnózist megerősítheti. Prognosztikus szerepe, a fenotípus kialakítása szempontjából általában alárendelt. Családtagok rizikójának a vizsgálatára általában nem használható, a pozitív lelet klinikai jelentősége – szemben bizonyos monogénes betegségekkel nem tisztázott.
Genetikai tanácsadás lelki hatásai
Végezetül a genetikai tanácsadás és tesztelés elfogadásáról és lelki hatásairól is érdemes megemlékezni, hiszen az érintett családokban-családtagokban ez szó szerint életbevágó kérdés. Irodalmi adatok szerint a herediter nonpolyposis szindrómás családokban a genetikai vizsgálatok a klinikai diagnózist lényegesen nem segítették, a tudott génmutáció azonban gyakran vezetett frusztrációhoz.
Az egyéni és társadalmi következményeket (tanulás, munkaválasztás, családalapítás, biztosítási szempontok, jogi, személyiségi szempontok) nem vizsgálták, ezt megbecsülni sem könnyű. Ennek alapvetően az sem mond ellen, hogy bizonyos betegségek esetén (pl. Wilson-betegség, FAP) a tünetmentes családtagok azonosítása és kezelése vagy korai szűrése a beteg életét mentheti meg.
Ilyenkor is kérdéses azonban, hogy milyen életkorban célszerű vagy javasolható a genetikai vizsgálat elvégzése. A kérdés persze nem csak ebben a vonatkozásban merül fel: meddig szabad elmenni a rutinszerű vélt vagy valós kapcsolatokat feltáró genetikai tesztelésben és milyen következmények árán?

Szerző: Griffel Tibor
Végzettség: ELTE – Eötvös Loránd Tudományegyetem. Szakterület: a szív- és érrendszeri betegségek, gasztroenterológiai betegségek és a légzőrendszeri betegségek. Jelenleg reflexológus, életmód és tanácsadó terapeuta tanulmányokat is végzek.