Coeliakia (lisztérzékenység), diagnózisa, terápiája
Kulcsfontosságú megállapítások
- A coeliakia a gabonafélék gluténfrakciójának alkohololdékony komponense által genetikailag prediszponált egyénekben provokált automimmun betegség, ami vékonybél-boholyatrophiával jár.
- A vékonybél-károsodás reverzibilis, gluténmegvonással az esetek többségében gyógyítható.
- A betegség báramely életkorban megjelenhet, szűrővizsgálatok egybehangzó eredményei szerint gyakori.
- Klinikailag lehet manifeszt, látens és csendes (silent). Ritka a potenciális és a refrakter forma.
- Genetikai szempontból HLA-asszociált betegség, de néhány százalékban nem HLA-gének is prediszponálnak a betegség kialakulására.
- Diagnosztikus kritériumok a pozitív szerológia (szöveti transzglutamináz-ellenes antitest – tTG) és a vékonybél-nyálkahártya szövettani vizsgálata.
- A szerológiai módszerekkel vált lehetővé nagy létszámú betegcsoportok szűrővizsgálata.
- A gluténszenzitivitás sok esetben extraintesztinális formában nyilvánul meg, tehát szisztémás betegség.
- Fennállására feltétlenül gondolni kell l-es típusú diabetes mellitusban, autoimmun kórképekben, tisztázatlan eredetű májműködési zavarnál, primer neurológiai vagy konvencionális metabolikus okokra vissza nem vezethető neurológiai tüneteknél, ismeretlen okú ginekológiai és andrológiai zavaroknál.
- Gluténmentes diétát nem követő gluténszenzitív egyéneknél a malignus betegségek (különösen lymphomák) kialakulásának a kockázata magas.
- A coeliakia kezelésének alapja a gluténmentes diéta következetes betartása.
- A coeliakiás betegek folyamatos gondozást igényelnek, klinikai státusuk vagy laboratóriumi paramétereik érdemi megváltozása esetén részletes vizsgálatokra van szükség.
A coeliakia (lisztérzékenység, gluténszenzitív enteropathia, nem trópusi sprue) a vékonybél krónikus, malabszorpcióhoz vezető betegsége, amelyet a genetikailag fogékony egyénekben az étkezéssel bevitt glutén idéz elő. A betegség és bizonyos gabonafélék között fennálló oki kapcsolatot W. Dicke, holland gyermekgyógyász ismerte fel 1950-ben.
A coeliakia patogenezisében genetikai, környezeti és immunológiai tényezők játszanak szerepet: a jelenlegi álláspont szerint a kórképet, amelynek lefolyása és aktivitása a külső, étkezéssel bevitt fehérjétől függ, autoimmun patomechanizmusú szisztémás betegségnek tekintjük. A megbízható szerológiai módszerek széles körű elterjedésével nyilvánvalóvá vált, hogy a coeliakia lényegesen gyakoribb, mint azt korábban gondoltuk, és a betegség klinikuma gyermek- és felnőttkorban egyaránt megváltozott.
Tünetek
A coeliakiás betegek többségét klinikai tünetek hiányában nem ismerjük fel, ezek az ún. silent (más néven: szubklinikus), illetve a látens csoportba sorolhatók. Vannak azonban tünetekkel járó (manifeszt) fel nem ismert esetek is. A silent coeliakia csoportba tartozó betegek vagy teljesen tünetmentesek, vagy csak minor, fel nem ismert tüneteik vannak, de vékonybél-nyálkahártyájuk kóros viszonyokat mutat.
A látens csoport betegeinél hagyományos étrend mellett is ép vékonybélnyálkahártya található, de vagy korábban volt boholy-atrophiát igazoló biopsziájuk, vagy pedig a későbbiek során alakul ki a gluténmegvonásra jól reagáló szövettani elváltozás. A látens csoport tagjainál a boholy- és cryptaszerkezet ép, ezért a szövettani leletet nem minősítik kórosnak. Az IEL-szám és az aktuális gluténterhelés mértéke között szoros korreláció áll fenn. A látens coeliakia egyéb kritériumait teljesítő betegeket, akikben sem korábban, sem aktuálisan nem áll fenn nyálkahártya-lézió, az ún. potenciális sprue alcsoportba soroljuk.
Epidemiológia
A coeliakia prevalenciája és a betegség megjelenésének időpontja drámaian megváltozott az elmúlt 30-40 évben. Korábban gyermekkori betegségnek tartották, a diagnosztizált gyermekek többsége 2 évnél fiatalabb volt. Ma már egyértelmű, hogy a coeliakia báramely életkorban jelentkezhet. Egy 2009-ben megjelent tömegszűrésről beszámoló közleményben a vizsgált katalán populációban a coeliakia gyakorisága 1,39% (~ 1:70) volt.
- Cöliákia – Gyakori kérdések
- Glutén – mikor vezessük be gyermekünknél?
- Lisztérzékenység tünetei, kezelési lehetőségek
Ezek a cikkek is érdekelhetnek:
A coeliakia hazai prevalenciáját Korponay-Szabó és munkatársai vizsgálták gyermekek, illetve a coeliakiás gyermekek családja körében. Az általuk kidolgozott többlépcsős szűrési rendszerrel az IgA-hiányos coeliakiás betegeket is felismerték. A vizsgált 3-6 éves gyermeknél 1:85 arányú prevalenciát állapítottak meg. Ismert coeliakiás betegek családjait vizsgálva az elsőfokú rokonok 8,5%-ában diagnosztizáltak coeliakiát.
A betegség szignifikánsan gyakrabban fordult elő a testvérek és az utódok körében, mint a szülőkben. Később ugyanez a munkacsoport az időközben elérhetővé vált tTG alapú gyorsteszt (point-of-care testing, POCT) segítségével 6 éves gyermekek körében végzett szűrést, és szoros összhangban a 2009-es spanyol közleménnyel, szintén 1,4%-os gyakoriságot észleltek.
Patogenezis
A coeliakia kialakulásához genetikai prediszpozíció, exogén provokáló ágens és autoantigén szükséges. A betegség manifesztálódásához azonban más, minden részletében nem ismert tényezők is szükségesek. Együttes meglétük esetén a gliadintoxicitás eredményeképpen a nyálkahártya átalakul, a bolyhok ellapulnak, a crypták kompenzatorikusan megnyúlnak és megnagyobbodnak, sejtjeikben jelentősen megnő a mitotikus aktivitás, az intraepithelialis limfociták száma nő. Az ellapult felszíni epitheliumban csökken az enzimatikus aktivitás. A coeliakia HLA-asszociált betegség, legszorosabb összefüggésben két MHC II. osztályba tartozó alléllel (DQA1*0501 és DQB1*0201 vagy DQB1*0202) áll, amelyek az immunválaszban részt vevő sejtfelszíni HLA-DQ2 fehérjét kódolják.
Exogénprovokáló tényező a gabonafélék fehérjéjének prolaminrésze. A toxikus hatásokat a búza gluténfrakciójának alkohololdékony komponense (gliadin), a rozs (secalin), az árpa (hordein) egyaránt provokálja. A zab (avenin) prolaminfrakciói valószínűleg szintén toxikusak coeliakiás betegekben, de feltehetően nem mindenkiben. A gliadin és a többi prolamin 250-650 aminosavterjedelmű, molekulatömegük 25 és 75 kDa között van. A toxicitás elvesztéséhez legalább 7 kDa molekulasúly leszakadására van szükség. In vitro és in vivo kísérletekben a toxicitást főleg egy 33 aminosavat tartalmazó peptid szekvencia (33-mer) idézte elő.
A coeliakia legfontosabb autoantigénje a szöveti transzglutamináz (tissue-transglutaminase-tTG). A szervezetben mindenütt előforduló aktív kalcium-dependens enzim a kovalens izopeptidil-kötések képződésének katalizátora. A donorproteinek glutaminjait az akceptorproteinek lizinjeivel kapcsolja össze. Legfontosabb funkciója, hogy a károsodott szövetek regenerációját az extracelluláris proteinek keresztkötésével segíti.
A táplálékkal bejutott gliadin a szöveti transzglutaminázhoz kapcsolódik. Az enzim a gliadinok, illetve más fehérjék között hálózatot alakít ki. Bakteriális vagy virális fertőzések egy része képes a szubklinikus coeliakiát aktiválni, mert megnő a gliadinbeáramlás és a szöveti transzglutamináz-aktivitás („up-regulation”). A szöveti transzglutamináz a gliadinpeptidek deamidálása révén, olyan peptidepitopokat hoz létre, amelyekhez a HLA-DQ2 fehérje képes kapcsolódni.
Ezen epitopként működő peptidek – a feltételezések szerint – a szöveti transz-glutaminázzal komplexet képezve neoepitopként viselkedve indítják be a CD4+ T-sejtek által vezérelt autoantitest-képzést. Ez a lépés jelentheti az immuntolerancia megszűnését és az autoimrnun folyamatok elindulását.
A coeliakiás betegek vékonybél-nyálkahártyája
A nyálkahártya-károsodás patomechanizmusára jelenleg az ún. kétszakaszos elmélet az elfogadott, amely szerint a genetikailag determinált, látens coeliakiára rakódik rá egy második károsító hatás, ami lehet megnövekedett gliadinterhelés és/vagy – főképp virális eredetű – fertőzés hatására kialakult permeabilitási zavar. Molekuláris mimikrinek nevezzük azokat az infekció által elindított autoimrnun folyamatokat, amelyek az infekció lezajlása után is fennmaradnak, sőt progrediálhatnak. A coeliakia patogenezisét kutatva korábban az adaptív immunitás túlsúlyára utaló eredmények születtek. Ma már egyértelmű, hogy a természetes immunitásnak (azon belül pl. az IL-15 citokinnek) is kitüntetett szerepe van a betegség kifejlődésében.
A coeliakiás betegek vékonybél-nyálkahártyáján már egy órával a gliadintartalmú táplálék fogyasztása után specifikus elváltozások észlelhetők. Mind a bélhámsejteken, mind a makrofágokon megnő a HLA-DR expressziója. A nyálkahártya azonban nemcsak a lumen, hanem a stroma felől is károsodhat, amelynek során a limfociták az epitheliumba vándorolnak, és különböző citokinek felszabadítása révén crypta- és boholyelváltozásokat idéznek elő. Ép vékonybélben az intraepithelialisan elhelyezkedő limfociták (IEL) száma 6-40/100 epithelsejt, coeliakiában 70-120/100 epithelsejt.
Klinikai tünetek
A gliadin hatására a vékonybél nyálkahártyáján bekövetkezett károsodás a felszívódás drasztikus romlásához és végül fordított irányú transzporthoz, azaz szekrécióhoz vezet. A „tight-junction”-struktúrák sérülése a szerves molekulák, továbbá a víz és az elektrolitok elvesztését eredményezi. A coeliakia klasszikus vezető tünetei a nagy tömegű, laza konzisztenciájú, nagy zsírtartalmú széklet, a következményes anaemia, gyengeség, fáradékonyság vagy állandó fáradtság érzése, fogyás, meteorizmus, vérzékenység, enterogen ödéma, a kalciumanyagcsere zavara, tetaniform-görcsök.
Gyermekkorban a növekedés és fejlődés elmaradása, alacsony termet a legszembetűnőbb. A coeliakia klinikai képe rendkívül színes, számos tünet mindenféle kombinációban előfordulhat. A coeliakiás betegek gyakorta oligoszimptómásak, felnőttkorban gyakori, hogy izolált malabszorpció (pl. vas) okozta enyhe tünet áll csak fenn. Ilyenkor lényegesen nehezebb a diagnózis felállítása, mert a betegség lehetősége sem merül fel. Gluténmentes diéta (GMD) bevezetése után – a ritka refrakter esetektől eltekintve – a tünetek megszűnnek, és a vékonybél kóros szöveti képe is rendeződik (a klinikum javulása rendszerint hónap okkal-évekkel megelőzi a szöveti szerkezet helyreállását).
Vashiány
Gyakran a vashiányos anaemia a coeliakia egyetlen megnyilvánulása, ezért ismeretlen eredetű krónikus microcytaer anaemiában indokolt szerológiai vizsgálat és/vagy vékonybél-biopszia elvégzése. A coeliakia talaján kialakult vashiányos anaemia Paterson-Brown-Kelly-szindrómához (Plummer-Vinson-szindróma) is vezethet. A felnőtt coeliakiás betegek két leggyakoribb tünete a microcytaer anaemia és az állandó fáradtság érzése.
Fontos tudni, hogy emésztőrendszeri tünetet csak az esetek kb. ötödében észlelnek. A betegség korai felismerése nemcsak az egyén számára, hanem még gazdasági szempontból is fontos. A későn felállított diagnózis és a következményes osteoporosis, infertilitás, malignitás kezelésére fordított összeg meghaladja a nagy embercsoportokat felölelő szűrések költségeit.
Társuló betegségek
A HL A DR3-DQ2 haplotípusú autoimmun betegségek bizonyítottan szoros kapcsolatban állnak a coeliakiával. Az l-es típusú (korábban inzulindependens) diabetes mellitus halmozott előfordulása a legjelentősebb. Coeliakiás betegek 5,4%-ában igazolták inzulindependens diabetes mellitus fennállását, szemben az életkor és nem szerint megfeleltetett népességben leírt 1,5%-kal.
Diabeteses gyermekekben a coeliakia társulására általában nem emésztőrendszeri tünetek, hanem a gyermekek fejlődésbeli elmaradása, csökkent hossznövekedése, a cukoranyagcsere nagyfokú labilitása (Mauriac-szindróma) és az indokolatlan hypoglykaemiák utalnak.
Coeliakiások között – a kontrollcsoporthoz (0,3%) képest – jelentősen nagyobb a Sjögren-szindróma gyakorisága is (3,3%). Gyakoribb a betegség előfordulása még a szintén autoimmuneredetű alopecia areatában is. Diétával a haj részleges vagy akár teljes visszanövése is elérhető. A coeliakia diagnózisához olykor ízületi panaszok vezetnek el. A nefrológiai kórképek közül az IgA-nephropathia, kardiológiai betegségek közül pedig az idiopathiás dilatativ cardiomyopathia halmozott előfordulását figyelték meg.
A tisztázatlan eredetű transzaminázszint-emelkedés hátterében az esetek 9%-ában áll coeliakia. A coeliakiás betegek májkárosodását kétféle elmélettel lehet magyarázni. Az első szerint a májkárosodásért a kórosan megnövekedett bélpermeabilitás révén a portalis keringésbe bekerülő nagymennyiségű toxin és potenciálisan káros antigén tehető felelőssé. A másik elmélet a coeliakia szisztémás jellegéből kiindulva, a májkárosodást a többi szervet, illetve szervrendszert is potenciálisan involváló autoimmun folyamat részjelenségének tartja.
Coeliakiás hepatitis
Az esetek többségében ún. coeliakiás hepatitist észlelünk, amelynek jellemzője, hogy benignus, klinikai jele nincs, hepatosplenomegalia nincs, az enyhe gyulladás diétára reverzibilis, az emelkedett transzamináz-értékek a GMD bevezetését követően normálissá válnak. Az esetek kisebb részében sikerül a coeliakiához társuló, önálló entitást képező májbetegséget (zsírmáj, primer szklerotizáló Cholangitis, primer biliaris cirrhosis, autoimmun hepatitisek) igazolni. Ilyenkor a krónikus májbetegség klinikai jelei észlelhetők. GMD-re nem múlik el, így az egyébként szokásos gyógyszeres kezelésre van szükség.
Hyposplenismus
A coeliakiás betegekben hyposplenismus alakulhat ki, ami GMD-vei részlegesen visszafordítható. Gyakoriságára vonatkozóan eltérő adatok ismertek (33-76%). Hyposplenismusban a fagocita sejtek baktericid aktivitását serkentő természetes tetrapeptid aktivitása csökken, ezért a beteg a bakteriális fertőzésekre fogékonyabb. A hyposplenismus gyakoriságát és súlyosságát legkifejezettebben a gluténexpozíció időtartama határozza meg.
A coeliakia leggyakoribb neurológiai szövődménye az ataxia. A látens coeliakiás betegekben gyakran ez az egyetlen klinikai tünet, ezért idiopathiás ataxia esetén célszerű az antitestszűrés elvégzése. Előfordul az agy okcipitális régiójában kalcifikáció, ami epilepsziát válthat ki. Viselkedési zavarok, depresszív tünetek is coeliakia gyanúját kelthetik a hagyományos antidepresszáns kezelésre nem reagáló betegeknél. Az ilyen betegeknél a GMD bevezetése után a depresszió gyors oldódását figyelték meg.
A GMD-t nem tartó coeliakiás nőkben a reproduktív idő megrövidül (kései menarche, korai menopauza), gyakoribb a szekunder amenorrhoea, csökken a fertilitás (relatív infertilitás), szignifikánsan gyakoribb a rekurráló spontán abortusz, megrövidül a szoptatási idő, gyakoribb a magzati halvaszületés, nagyobb a perinatalis halálozási arány, megnő az intrauterin retardáció veszélye, és fokozottabb a velőcsőzáródási rendellenesség (nyitott gerinc) kockázata is. Előfordul, hogy a coeliakia szövődménymentes szülés után manifesztálódik.
A coeliakia nem egyszerűen a táplálékkal bevitt glutén iránti intolerancia, hanem potenciálisan a legkülönbözőbb szerveket érintő szisztémás betegség. Folyamatosan bővül azon betegségek, tünetek köre, amelyekben coeliakia irányában (legalább) szerológiai szűrést kell végezni. Feltétlenül célszerű coeliakia után kutatni l-es típusú diabetes mellitusban, autoimmun kórképekben, tisztázatlan eredetű transzamináz-emelkedésben, illetve neurológiai tüneteknél, ismeretlen okú gynekológiai és andrológiai zavaroknál, fogzománc-hypoplasia esetén. A felismert coeliakia nyomán megkezdett GMD segítségével javul az életminőség, sőt gyakran javulás áll be a társuló betegségeknél is.
A coeliakia szövődményei
Lidiopathiás osteoporosisban szenvedő betegekben tízszer gyakoribb a coeliakiaspeciíikus szerológiai pozitivitás, mint ha a csontsűrűség normális. A coeliakiát kísérő metabolikus osteopathia hasi tünetek nélkül is kialakulhat, csonfájdalomhoz, pszeudofraktúrákhoz vagy deformitásokhoz vezethet. Klinikai tünetek hiányában is gondolni kell osteomalaciára csökkent szérumkalcium- és foszfátszint vagy emelkedett alkalikus foszfatáz fennállásakor. Ilyen esetekben szérum-D-vitamin- [25(OH)D3] és parathormonszint meghatározása szükséges.
Csontsűrűség
A csökkent csontsűrűség oka a kalcium és a magnézium csökkent felszívódása, a következményes szekunder hyperparathyreosis és a D-vitamin-raktárak gyorsult mobilizálása lehet. Aktív coeliakiás betegekben további kóroki tényező lehet a D-vitamin-dependens kalciumkötő fehérje, a calbindin-D9k szignifikánsan csökkent aktivitása.
Laktózintolerancia
A coeliakiát gyakran kísérő laktózintolerancia esetén a tej- és tejtermékek csökkent fogyasztása miatt kicsi a kalcium-bevitel. Coeliakiás betegekben oszteodenzitometria végzése szükséges, mert alkalmas szűrésre, valamint a csontsűrűség GMD hatására bekövetkező változásának követésére. Tartós GMD hatására a csontsűrűség jelentős növekedését észlelték. A csontsűrűség csökkenésének maradéktalan rendeződése felnőttkorban lényegesen ritkább, ezért a korai diagnózis a legfontosabb.
A felnőttkori coeliakiás betegek egy része (7-30%) nem reagál GMD-re. GMD-re nem javuló betegnél elsőként a szándékos vagy vétlen diétahibát (számos élelmiszer, tartósítószer és gyógyszer, például egyes antacidák tartalmaznak vivőanyagként vagy „szennyeződésként” glutént) kell felderítenünk. Ha a panaszok oka egyértelműen nem diétahiba, akkor felül kell vizsgálnunk a coeliakia diagnózisát, ki kell zárnunk más betegség, pl. lymphoma fennállását.
Diagnózis
Szerológiai módszerek
A coeliakiára specifikus szerológiai markerek megváltoztatták a betegség epidemiológiájával kapcsolatos ismereteinket, és elsődleges módszerré váltak mind a diagnózis felállításában, mind a szűrésben és az ellenőrzésben.
A coeliakia diagnosztikájában – az antigliadin antitest (AGA) és az antireticulin antitest (ARA) meghatározást felváltva – kiemelkedően magas szenzitivitása és specificitása miatt az IgA EMA (endomysium-ellenes antitest) vizsgálat terjedt el világszerte. Hátránya, hogy az indirekt immunfluoreszcencia elvén működő technika kiértékelése nagyban függ a vizsgáló tapasztalatától, a társultan fennálló IgA-hiány miatt nem használható a coeliakiás betegek 3-10%-ában, valamint az assay szubsztrátja többnyire a drága és nehezen elérhető majom nyelőcső. Az autoantitestek legfőbb targetantigenje a szöveti transzglutamináz (tissue transglutaminase = tTG) 2-es izoenzimje (tTG2). A humán szöveti transzglutamináz-szubsztráton alapuló ELISA-technika költséghatékony eljárás, ezért alkalmas a tünetes, illetve a tünetmentes coeliakiás esetek felkutatására.
Magyar szerzők humán szöveti transzglutamináz-szubsztrátot használva 98%-os szenzitivitásról és 98%-os specificitásról számoltak be. A bevezetését követő néhány évben szinte teljesen kiszorította az EMA-t és egyéb szerológiai módszereket. Megjegyzendő, hogy az egyes ELISA-kitek megbízhatósága, diagnosztikus pontosága között jelentős eltérések vannak, tehát metodikai okokból találkozhatunk álnegatív (ritkábban álpozitív) eredményekkel.
Az elmúlt 5 évben jelentek meg az ágy melletti, kapilláris vért felhasználó gyorstesztek (point-of-care testing, POCT), amelyek szenzitivitása és specificitása megközelíti a vénás véren alapuló ELISA-módszerek pontosságát. A legfrissebb szerológiai lehetőség az ún. deamidált gliadinpeptidekre (DGP) épülő metodika, amelynek pontos helye a diagnosztikában még nem világos.
Endoszkópia
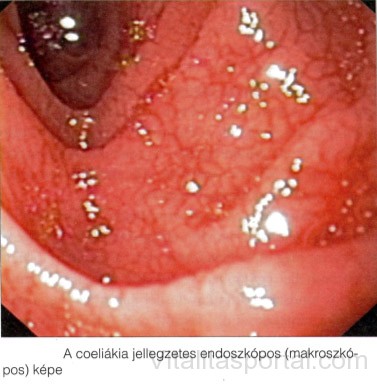
A súlyos bélboholy-károsodással járó manifeszt coeliakiás betegekben típusos, de nem specifikus endoszkópos eltéréseket láthatunk. Enyhe szöveti károsodás esetén makroszkópos eltérés nincs. A coeliakia jellegzetes endoszkópos megjelenése a Kerkring-redőzet szegényessége, ellapulása, csipkézett kontúrja („scallopped folds”). A nyálkahártya néha ödémás, különösen biopsziavétel vagy festés után páfrány- vagy mozaikszerű rajzolat figyelhető meg.
Ritkán felületes, multiplex hámhiány jelenhet meg, főleg a postbulbaris duodenumban. Ilyenkor gyulladásos bélbetegség (Crohn) vagy infekció merül még fel. Főleg a kapszulás endoszkópia elterjedésével nyert bizonyítást, hogy a coeliakia is lehet foltos elhelyezkedésű. Az endoszkóposán felismerhető nyálkahártya-elváltozások többsége, a korábbi ismereteinkkel összhangban, a proximális vékonybélre lokalizálódik. A coeliakia diagnózisát szövettani vizsgálat nélkül sem felállítani, sem elvetni nem lehet.
Szövettan
A coeliakia diagnosztizálásához szükséges kritériumok az elmúlt évtizedekben többször is megváltoztak. Az 1970-ben felállított eredeti ESPGAN (European Society of Paediatric Gastroenterology and Nutrition) kritériumok alapvetően gyermekekre vonatkoztak, és három vékonybél-biopsziát írtak elő (alap, GMD után, glutén-terhelést követően). Az 1990-ben elfogadott, ún. módosított ESPGAN-kritériumokban már nem szerepel a klinikai javulást követően a diagnózis végső megerősítése céljából végzett gluténterhelés. A coeliakia diagnózisát megerősíti a GMD-ra negatívvá váló, megelőzően pozitív eredményű szerológiai vizsgálat.
Felnőttkorú betegeknél a biztos diagnózishoz a duodenum- vagy jejunum-biopszia elengedhetetlen. A lehetőség szerint még diéta bevezetése előtti állapotban történt biopsziavétellel egyidőben szerológiai vizsgálat is szükséges. A rendszeres utánkövetésnél már kizárólag a szerológiára támaszkodunk. Felnőtt coeliákiásokban, ha a GMD-ra tünetileg jól reagálnak, és szerológiai regresszió is észlelhető, akkor kontrollbiopszia nem kötelező. Felnőtteknél a nyálkahártya teljes restitúciója akár két évig is eltarthat, ezért, ha ismételt mintavétel válik szükségessé, a GMD kezdésétől egy évet célszerű kivárni.
A szövettani képet boholyatrophia, a következményesen kialakult crypta-hyperplasia miatt a boholy és a crypta arányának csökkenése, a cryptákban megnövekedett mitotikus aktivitás, az epithelsejtek pusztulása és az intraepithelialis limfocitaszám (IEL- CD3 pos.) megnövekedése jellemzi. A nyálkahártya-károsodás pontos szöveti leírására ma a módosított Marsh-klasszifikációt használjuk. A diétanaiv (GMD-vei még nem kezelt) coeliakia gyanús betegek kivizsgálásakor szerológiára és szövettani vizsgálatra épülő algoritmust követünk.
Differenciáldiagnózis
A coeliakiától számos boholyatrophiával járó betegség különítendő el. Külön említést érdemel egy viszonylag újonnan leírt kórkép, az autoimrnun enteropathia, amelyre a semmilyen diétás megszorításra nem reagáló boholyatrophia és az enterocita-ellenes autoantitestek jelenléte jellemző. A betegséget először gyermekeken írták le, felnőttkori manifesztációjáról elsőként 1997-ben számoltak be. Valószínűleg néhány, korábban refrakter coeliakiának tartott esetben valójában autoimrnun enteropathiáról volt szó.
A boholyatrophiával járó egyéb betegségek gyakran foltos elrendeződésben involválják a vékonybelet, ezért a biopsziák egy részében normális viszonyokat látunk, máskor pedig különböző súlyosságú boholyellapulást észlelhetünk. A legkifejezettebb nyálkahártya-károsodást a B-sejtes, immundeíiciens állapotokban, az ún. common variable immundeíiciency (CVI) betegségben és az ún. late onset agammaglobulinaemiában írták le. T-sejtes immunhiányos állapotban lényegesen kisebb a boholyatrophia mértéke; korábban ezzel a ténnyel kívánták közvetve bizonyítani a T-sejtek szerepét a nyálkahártya-károsodás mechanizmusában.
Terápia
Diétás kezelés
A coeliakia kezelésének alapja a gluténmentes diéta (GMD). A különleges táplálkozási célú gluténmentes diétás élelmiszereket a Codex Alimentarius definiálja – a végleges szabály 2008-ban végén került elfogadásra.
Eszerint a gluténmentes diétás élelmiszerek összetevőinek gluténtartalma:
- nem lehet több mint 20 mg/kg, ha az adott készítmény glutént nem tartalmazó (természetes gluténmentes) összetevőkből készül
- nem lehet több mint 100 mg/kg, ha az adott készítmény ún. gluténmentes minőségű búzakeményítőből készül
- nem lehet több mint 100 mg/kg, ha az előző két kategóriába tartozó összetevők keverékéből készül.
A követéses vizsgálatok szerint a coeliakiás betegek csak 50-70%-a tartja be egész életében a GMD-t, ezért a javulás elmaradása többnyire a beteg nem kielégítő együttműködéséből fakad. A betegek és az orvosok gyakran rosszul értesültek az egyes ételek gluténtartalmáról. Alapvető, hogy a GMD bevezetésekor tapasztalt dietetikus ismertesse a beteggel a szükséges étrendi módosításokat, és a hagyományos élelmiszerek toxicitását. Mindez különösen a tünetmentes vagy csak enyhe tünetekkel rendelkező betegeknél fontos.
Tudatosítani kell a betegben, hogy a GMD következetes, éveken át tartó betartásától az emésztőszervi panaszok javulása, a testsúly és az ellenállóképesség növekedése, a csontsűrűség – legalább részleges – restitúciója, a társuló betegségek enyhülése vagy megszűnése, a rosszindulatú daganatok kockázatának az átlagpopulációnál észlelt szintre való csökkenése várható.
A GMD-vel kapcsolatban a gasztroenterológus legfontosabb, a gyakorlatban mégis sajnálatosan ritkán betöltött szerepe, hogy a betegségével frissen szembesülő beteget megnyugtassa, és eljuttassa olyan dietetikushoz, illetve coeliakiás betegcsoporthoz, ahol a beteg napi szintre lebontott konkrét diétás segítséget, és nem csak irányelveket kap. Súlyos boholyatrophia esetén reverzibilis laktázhiány áll fenn, ezért a GMD bevezetésével egyidőben célszerű átmenetileg a laktóztartalmú táplálékoktól (tej- és tejtermékek) tartózkodni.
Szteroid kezelése
A refrakter coeliakia esetén a legtöbb szerző szteroiddal kezdi a kezelést. A szteroidigény csökkentésére azathioprin adását is megkísérelték, néha sikerrel. Az azathioprin azonban tovább súlyosbítja a szteroidterápia által előidézett immunszupprimált állapotot a már eredetileg is rossz általános állapotú betegekben.
Folyamatos, nem befolyásolható fogyás, hanyatló általános állapot esetén, a fenti terápiás lehetőségeket kiegészítve, átmenetileg teljes vagy kiegészítő parenteralis táplálásra is szükség lehet. A 2-es típusú refrakter coeliakiás betegek jelenleg elfogadott legkorszerűbb kezelése a cladribine és az autológ őssejt transzplantáció kombinációja.
Gyógyszeres kezelési lehetőségek
A diéta betartása nem mindig könnyű, ezért jogos igény, hogy a betegséget más módon, lehetőleg gyógyszeresen is kezelni lehessen. Nehézség az is, hogy a coeliakia kialakulásáért számos, eltérő kromoszómákon lokalizálódó gén, továbbá epigenetikus faktorok és környezeti elemek a felelősek. A betegek az egyes gliadinfragmentumokra eltérő módon érzékenyek, ezért is nehezen képzelhető el egyetlen, általánosan jól működő gyógyszer kifejlesztése. A coeliakia patomechanizmusának fokozatos megismerése több lehetséges terápiás célpontot is feltárt.
Az angol szaknyelvben a két fő irányt a 2M-mel jelölik, ahol az első „M” a bevitt gabonaféleség módosítása, a második „M” pedig a toxikus fehérjék által kiváltott immunválasz módosítása.
- Az első „M” témakörébe tartozik a vékonybélbe juttatott, természetes eredetű gabonafehérjék emésztés útján történő módosítása. A gliadin toxicitását jelentős részben az emésztésnek ellenálló glutamin- és prolincsoportok okozzák. Egyes endo- és exopeptidázok azonban képesek a gliadin felhasítására a lumenben, megakadályozva ezáltal, hogy a vékonybél nyálkahártyája felől a kóros immunválasz beinduljon. Nyilvánvaló, hogy létezik egy küszöbdózis, amely feletti gluténbevitellel az enzimes előemésztés nem tud megbirkózni, ezért ez a módszer elméletileg is a GMD kiegészítője, nem pedig helyettesítője lehet.
- A kóros immunválasz befolyásolása (a második „M”)
- Elvi lehetőség a sejtadhéziós molekulák gátlása.
- Jelenleg a legtöbb vizsgálatot egy, a paracellularis permeabilitas fokozódását előidézni képes fehérje, az ún. zonulin gátlására alkalmas molekulával (larazotid-acetát, AT1001) folytatják.
- A probiotikumoknak az eddigieknél nagyobb és tudatosabb szerepük lehet a coeliakia kezelésében is. A probiotikumok bizonyítottan visszaszorítják a proinflammatorikus patogén mikroorganizmusokat, fokozzák a gazdaszervezet védekező képességét a szekretoros IgA-termelés stimulálásával, csökkentik a paracellularis permeabilitást (egyfajta természetes zonulin-inhibitorként), és kordában tartják a kóros immunválaszokat az IL-10-termelés és a regulátoros T-sejtek indukciójával.
Hangsúlyozni kell, hogy a coeliakia mindmáig elsőszámú kezelése a GMD. Minden további táplálékkiegészítőre vagy a patomechanizmus ismeretében kifejlesztett gyógyszerekre a közeljövőben is csak a GMD kiegészítőjeként számíthatunk. A jövő nagy kérdése, hogy a felsorolt vagy más terápiás alternatívák alkalmasak-e a gyakorlatban történő bevezetésre.

Szerző: Griffel Tibor
Végzettség: ELTE – Eötvös Loránd Tudományegyetem. Szakterület: a szív- és érrendszeri betegségek, gasztroenterológiai betegségek és a légzőrendszeri betegségek. Jelenleg reflexológus, életmód és tanácsadó terapeuta tanulmányokat is végzek.